Водород - на
HYDROGEN
Н (лат. Hydrogenium),
лесният газообразен химичен елемент - член на IA подгрупа на периодичната система на елементите, понякога се нарича подгрупа VIIA. На земната атмосфера на водород в несвързаната състояние, има само една малка част от една минута, количеството на 1-2 части на 1 500 000 части на въздух. Той обикновено се означава с други газове в вулканична, от петролни кладенци и разлагането на големи количества органична материя. Водородът съчетава с въглерод и (или) на кислород в органичен вещество тип въглехидрати, въглеводороди, мазнини и животински протеини. Хидросферата водород включени във водата - най-изобилен съединение в света. В скали, почви, почви, както и други части на кора водород комбинира с кислород, за да се образува вода и хидроксидни йони ОН-. Водородът е 16% от всички кора атома, но само около 1 тегловен%, тъй като тя е 16 пъти по-лек от кислород. Маса на Слънцето и звездите на 70% се състои от водород плазма: в пространството е най-разпространеният елемент. Концентрацията на водород в атмосферата увеличава с височина поради ниската си плътност и способност за изкачване на голяма височина. Намерено върху повърхността метеорити на Земята съдържа 6-10 водородни атоми на 100 силициеви атоми.
Исторически информация. Друг германски лекар и учен Парацелз през 16 век. Водородът избран запалимост. В 1700 N.Lemeri установено, че газ, отделян от действието на сярна киселина на желязо, експлодира във въздуха. Водородът G.Kavendish елемент идентифициран през 1766 и име "гориво въздух", и в 1781 той показа, че водата - е продукт на реакцията му с кислород. Латинска Hydrogenium, която идва от гръцката комбинация "се гонят вода", Лавоазие бе дадена на този елемент.
Общи характеристики на водород. Водород - първи елемент в периодичната таблица; атом се състои от един протон и въртене около един електрон
(Вж. Също Периодичната таблица).
Един от 5000 се характеризира с водородни атоми в ядрото на неутрон увеличава масата на ядрото с 1 до 2. Това се нарича водородни изотопи деутерий 21h или 21d на. Друг, по-рядко изотоп на водород се състои от две неутроните в ядрото и се нарича тритий 31H или 31Т. Тритий разпада на радиоактивни и освобождаване на хелий и електрони. Сърцевини различни водородни изотопи различават протонни завъртания. Водородът може да бъде получено от а) действие на активен метал към водата, б) действието на киселини на някои метали, в) действието на бази на силиций и някои амфотерни метали, ж) на действието на прегрята пара на въглища, и метан, както и желязо, г) електролитна разлагане вода и термичното разлагане на въглеводороди. Химическа водород активност се определя от неговата способност да дари електрони на друг атом или общуват му почти еднакво с другите елементи в образуването на химична връзка или придават друг елемент електрон в химично съединение, наречено хидрид. Водородът се произвежда в големи количества в търговската да консумират синтез на амоняк, азотна киселина, метални хидриди. В хранителната промишленост използва водород в продължение на хидрогениране (хидрогенирани) течни масла в твърди мазнини (например, маргарин). Hydrogenation наситен органични масла, съдържащи двойни връзки между въглеродните атоми, се превръщат в наситени они с единични връзки въглерод-въглерод. Високата чистота (99,9998%), течен водород се използва в космическите ракети като лесно запалим.
Физични свойства. Втечняване и втвърдяване на водород изисква много ниска температура и високо налягане (вж. Свойствата на Таблица I). При нормални условия, водород - газ безцветен, без мирис и вкус, много лесно: 1 литър водород при 0 ° С и атмосферно налягане има тегло 0.08987 грама (вж плътност на въздуха и хелий 1.2929 и 0.1785 гр / л съответно. ; обаче балон напълнен с хелий и със същия лифт като балон с водород, трябва да бъде 8% по обем). Таблица I показва някои от физически и термодинамични свойства на водород. СВОЙСТВА обикновен водородни
(В 273,16 К или 0 ° С)
Атомен номер 1 атомна маса 11Н 1.00797 плътност, г / л
0.08987 при нормално налягане при 2.5 х 10 5 атм 0.66 2.7 * 1.12 атм 18 октомври * 10 юли
Радиусът на ковалентна 0,74 температура на топене, ° С -259.14 точка на кипене, ° С -252.5 критична температура, ° С -239,92 (33,24 К) критичното налягане, банкомат 12.8 (12.80 K) специфична топлина J / (molChK) 28,8 (Н2) Разтворимост
във вода о / 100 обемни H2O (при стандартни условия) бензен в 2,148 мл / г (35,2 ° С, 150,2 бар) 11.77 амоняк мл / г (25 ° С) при 50 атм 4 47 при 1000 атм 79.25
Окисляване -1, 1
Структурата на атома. Неутрален водород (протий) се състои от две основни частици (електрони и протони) и има атомно тегло 1. Поради движението на висока скорост на електрони (2.25 км / S или 1015 * 7 об. / S) и дуалистичен еритроцитите вълна характер не е възможно точно да се определят координатите (позиция) на електрона в даден момент, но има някои области на високо вероятността за намиране на електрони, и определяне на размера на атом. Повечето от химичните и физичните свойства на водород, особено тези, принадлежащи към възбуждане (поглъщане на енергия) на математически точно прогнозира (вж. Спектроскопия). Водородът е подобен на алкалните метали във факта, че всички тези елементи са способни на даряване на електронен акцептор атом да образуват химична връзка, която може да варира от частично йон (електронен трансфер) към ковалентно (общо електронна двойка). Със силни водороден акцептор на електрони образува положителен йон Н +, т.е. протон. В електрон орбита водороден атом може да бъде 2 електрони, обаче, водород е в състояние да приеме електрон да образуват отрицателен йон Н, хидрид йон, и водород е общо с халоген, който се характеризира с приемането на електрон да образуват отрицателен тип СГ халид йон. водород дуализъм е отразено във факта, че в периодичната таблица на елементите, разположени в своите подгрупа IA (алкални метали), а понякога - (. виж също Chemistry) подгрупа VIIA (халогена).
Химически свойства. химичните свойства на водород на определя от един електрон. Количеството енергия, необходима за отделяне на електрона, повече, отколкото може да се получи всеки известен химически окислител. Поради химически водородна връзка с други атоми е по-близо до ковалентна от йонен да. Чисто ковалентна връзка възниква в образуването на водородни молекули: H + Н Н2
При образуването на един мол (т.е. 2 грама) Н2 освободен 434 кДж. Дори при 3000 градуса К на дисоциация на водород е много малък и равен на 9.03% при 5000 К достига 94% и само 10 000 K дисоциация се напълни. При образуването на два мола (36 г) вода от атомен водород и кислород (4Н + O2 -> 2H2O) разпределени повече от 1250 кДж и температурата достига 3000-4000 ° С, докато изгарянето на молекулярен водород (2Н2 + O2 -> 2H2O) освободен само 285.8 кДж и температура на пламъка достигне само 2500 ° С при стайна температура, по-малко реактивен водород. За започване на повечето реакции, необходими за да се прекъсне или да отслаби силна връзка Н-Н, като е прекарал много енергия. Реакциите на водородни увеличава с използването на катализатора (платиновата група метали, оксиди на преходни метали или тежки) молекули и методи за възбуждане (светлина, електрически разряд, електрическа дъга, високи температури). При тези условия, водородът реагира с почти всеки елемент с изключение на благородни газове. Активни алкални и алкалоземни елементи (например, литиеви и калциеви) реагират с водород, като донор на електрони и образуващи съединение, наречено сол хидриди (2Li + Н2 -> 2LiH Са + Н2 -> CaH2).
Обикновено хидриди са съединения, съдържащи водород. Голямо разнообразие от свойства на такива съединения (в зависимост от атом, свързан с водород), водородни функции обяснени проявяват заряд -1 до 1 практика. Това ясно се вижда в приликите и CaH2 LiH и вида на CaCl2 и NaCl соли. Смята се, че отрицателно заредените водородни хидриди (Н-); йон е редуктор в кисела водна среда: 2Н- H2 + 2e- + 2,25B. Н йон е в състояние да намали водната протон Н + с газообразен водород: Н + H2O (R) H2 + ОН-.
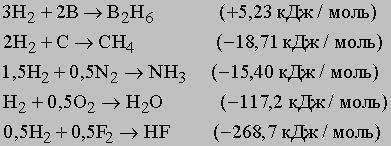
Съединения с борен водород - борани (борохидриди) - представляват необичайно класа на съединения, наречени борани. Най-простият представител е BH3, съществуващ само под формата на стабилна диборан B2H6. Съединения с голям брой на борни атоми, произведени по различни начини. Известно е, например, tetraborane B4H10, B5H9 pentaborane стабилна и нестабилна pentaborane B5H11, geksaboran B6H10, декарборан B10H14. Диборан може да бъде получена от BCl3 и Н2 чрез междинен B2H5Cl, което при 0 ° С до disproportionates B2H6, и взаимодействие на литиево-алуминиев хидрид LiH или LiAlH4 в BCl3. В литиево-алуминиев хидрид (комплексно съединение - физиологичен разтвор хидрид) четири водородни атоми образуват ковалентни връзки с Al, но йонна връзка с Li [[AlH4]] + -. Друг пример на водороден йон е йон борохидрид, BH4-. По-долу хидриди груба класификация в зависимост от техните свойства, в съответствие с позицията на елементите в периодичната таблица на елементите. Преход метални хидриди или метални наречен посредници и често не образуват стехиометрично съединения, т.е. съотношение на водород към метални атоми не се експресира в цяло число, като ванадий хидрид и хидрид VH0,6 торий ThH3,1. Платиновата група метали (Ru, Rh, Pd, Os, Ir и Pt) активно поглъщат водород и служат като ефективни катализатори за хидрогениране реакции (например хидрогениране на течни масла за образуване мазнини, азотни реализации за синтез на амоняк метанол CH3OH от СО). Хидриди на Be, Mg, Al и подгрупи Cu, Zn, Ga - полярен, термично нестабилна.

Неметали образуват летливи хидриди с формула MHx (х - е цяло число) с относително ниска точка на кипене и високо налягане на парите. Тези хидриди различават значително от физиологичен разтвор хидриди, в която водороден има отрицателен заряд. V летливи хидриди (например, въглеводороди) преобладава ковалентна връзка между водород и неметали. Тъй като усилването на неметални съединение формира характер частично йонна свързване, например Н + СГ, (Н2) 2 + O2-, N3- (H3) 3+. Специфични примери на образуването на различни хидриди, изброени по-долу (в скоби хидрид топлина на образуване):
4. Метод желязо пара, с която пара при 500-1000 ° С се пропуска през желязо: 3Fe + 4H2O Fe3O4 + 4H2 + 160,67 кДж. Получени по този метод, водород обикновено се използва за хидрогениране на мазнини и масла. Състав на железен оксид зависи от температурата на процеса; в п + (п + 1) Н2
6. Следващият обема на производството е метод метанол-пара: СН3ОН + Н 2О -> 3H2 + СО2. Реакцията е ендотермична и се провежда при VODOROD260 ° С в конвенционалните реактори стомана при налягане до 20 атмосфери. 7. Катализатор разлагане на амоняк: 2NH3 -> LiOH + Н2
(Този метод е подходящ за директно приложение на получения водород.) В реакцията на киселини с активни метали и водород се освобождава, но обикновено замърсен изпарения киселина или друг продукт газ, например фосфин PH3, сероводород H2S, арсин AsH3. Най-активните метали реагират с вода за образуване на водород и изместват алкохол: 2H2O + 2Na -> Н2 + 2NaOH Разпределени лабораторен метод за получаване на Н2 Kipp апарат цинк взаимодейства със солна или сярна киселина:
Zn + 2HCl -> ZnCl2 + Н2. Алкалоземни хидриди (например, CaH2), сол комплексни хидриди (например LiAlH4 или NaBH4) и някои борани (например, B2H6) чрез взаимодействие с вода или по време на термичната дисоциация на водород се изолира. Кафявите въглища и пара при висока температура също взаимодействат с отделянето на водород.
Пречистването водород. Степента на необходимата чистота на водород се определя от неговото прилагане. Сместа от въглероден диоксид се отстранява чрез замразяване или втечняване (например чрез преминаване на газовата смес чрез течен азот). Същият примес може да бъде напълно отстранен чрез барботиране през вода. CO може да бъде отстранена чрез каталитично превръщане на СО2 да CH4 или или втечняване при лечение течен азот. Смес от кислород, образуван по време на електролизата, вода се отстранява и след изпълнението на искра.
Използването на водород. Водородът се използва главно в химическата промишленост за получаване на хлороводород, амоняк, метанол и други органични съединения. Той се използва в хидрогениране на масла и (за превръщането на горива с ниско съдържание клас в високо качество) на въглища и петрол. Стоманата се намалява чрез използване на водород, някои цветни метали от техните оксиди. Водородът се използва за охлаждане на мощни електрически генератори. изотопи на водорода се използват в ядрената енергетика. пламък водород кислород се използва за рязане и заваряване на метали.
СПРАВКА
Некрасов BV Основи на обща химия. М. 1973 Liquid водород. М. 1980 водород в метали. М. 1981