Вода като разтворител
Основи на биохимия. физикохимията
Вода като разтворител
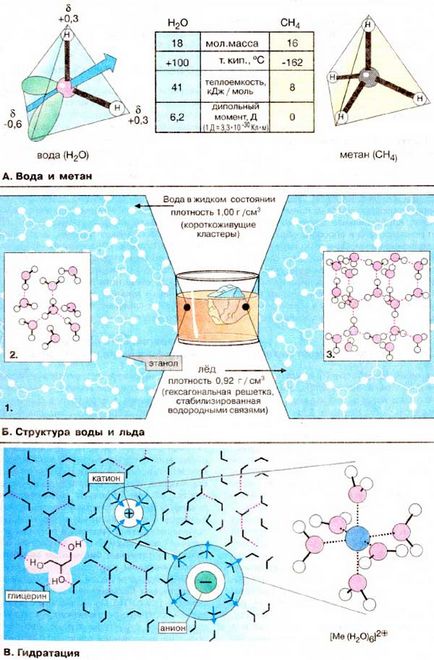
Уникалните свойства на вода Н2 О са очевидни, когато се сравнява с метан (СН4). Двете молекули са идентични по тегло и размери. Независимо от точката на кипене на водата при 250 ° С по-висока от точката на кипене на метан. В резултат на това водата на повърхността на земята е в течна и метан - в газообразно състояние. висока точка на кипене е следствие на висока специфична топлина на изпарение, който от своя страна се дължи на неравномерното разпределение на електронната плътност в молекулата на водата. Една молекула вода е под формата на тетраедър в центъра на който е кислороден атом. Две върховете на тетраедър са заети от свободни електронни двойки кислороден атом (зелен) и другите две - водородни атоми. Следователно, Н-О-Н връзките са под ъгъл един към друг. Освен това, поради високата електроотрицателност на кислородните атоми О-Н връзка е полярен (вж. Стр 14). Водород носят частичен положителен заряд от около 0.4, и кислороден атом - частичен отрицателен заряд от около 0.6, т.е., молекула вода е електрически дипол .. Следователно, всяка молекула на вода, като малко магнит привлича поради образуването на водородни мостове (В) четири молекули (вж. Стр 14). Когато водата се изпарява, унищожаването ztih множество водородни връзки изисква много енергия. метан неполярни молекули, диполи, и не са относително слабо взаимодействат един с друг. Поради това течен метан се изпарява при много ниски температури.
В. Структура на вода и лед
В биполярно структурата на водните молекули благоприятства образуването на водородни връзки (вж. Стр 14). В този случай всяка молекула показва свойствата на двата донора и акцептора на водород. Следователно, в много молекули вода в течно състояние са свързани чрез водороден "мостове" (връзки) (1). където получените сътрудници са в динамично равновесие. Често образувани тетраедъра структури, така наречените "клъстери" на вода (2). Когато температурата се понижава съотношението на клъстери увеличава до началото на кристализация. При нормално атмосферно налягане, вода кристализира при 0 ° С с по-голямата част от водните молекули са вградени в шестоъгълна решетка (3). Тъй като в твърдо състояние, разстоянието между молекулите средно висока, отколкото в течността, плътност лед-малко от плътността на водата. Това свойство на водата е много важно в екологичен смисъл на думата, дори и само защото зимата лед слой се образува, и те рядко се замразява до дъното в повърхностните води.
За разлика от повечето други течности Водата е идеално разтворител за дисоцииране вещества. В електрическо поле на даден йон, водните молекули образуват редовен структура в съответствие с такса йон. Този хидрат обвивка предпазва йон на противоположни йони зареждане. Водата има висока диелектрична константа на пропускливост (78), т.е. във вода електростатично привличане на две противоположно заредени йони се намалява с около 80 пъти (1/78). молекулите на водата в областта вътрешната разположен непосредствено до йон същество имобилизирани (прикрепена към йон) и се движат заедно с централната йон. Това е лесно разтворим във вода и неутрални съединения с повече хидроксилни групи, такива като глицерол (в диаграмата в ляво), или захари, тъй като те са способни да образуват водородни връзки с молекули на разтворителя.