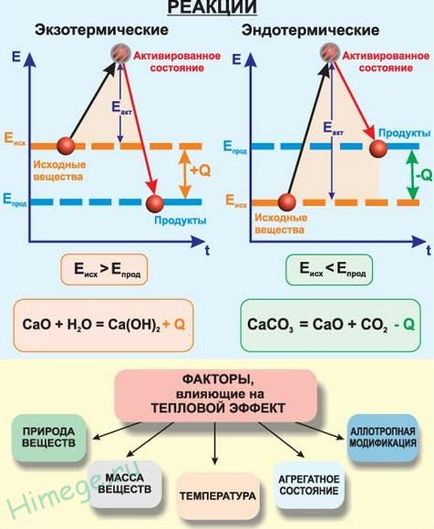
Топлинен ефект
Когато потокът от химически реакции настъпи скъсване на химични връзки между атомите в молекули на някои вещества и образуването на химични връзки между атоми в молекули на други вещества. Счупване на химичните връзки са свързани с потреблението на енергия, както и образуването на нови химични връзки води до освобождаването на енергия. Сумата от енергиите на всички прекъснати връзки и всички образованите не са равни, така че всички реакции да се провеждат с пускането или поглъщане на енергията. Енергията може да бъде освободен или абсорбира под формата на звукови вълни, светлина, работа разширяване или свиване и т.н. В повечето случаи, енергията на химична реакция освободено или абсорбира като топлина.
Изолиране или абсорбция на топлина в химическа реакция се нарича топлината от реакцията и определено от буквата Q.
Реакцията в хода на която топлината се освобождава и се пренася в околната среда се наричат екзотермична. и тези, в хода на която топлината се абсорбира от околната среда, наречена ендотермичен. Екзотермични реакции положителен термичен ефект отговорен + Q, и ендотермичен - отрицателен -Q топлина ефект.
Уравнения химични реакции, при които се дава на топлината от реакцията, се нарича термохимични. Термохимична уравнения показват едновременно агрегат разстояние вещества (кристален, течни, газообразни и т. Д) и могат да бъдат частични коефициенти.
Топлинният ефект зависи от реакционната температура и налягане, обаче, са склонни да доведе до стандартни условия, т.е.. Е. температура от 298 К и налягане от 101,3 кРа.
Топлинен ефект се изчислява чрез термо уравнението. Представено с формулата по-долу термохимична реакция водород изгаряне на кислород:
Н2 (д) + 1/2 2 (г) = Н2 О (ж) + 286 кДж
Това показва, че 1 мол водород или изгори на 1 мол от образуваната вода се разпределя 286 кДж на топлина (Q = 286 кДж, Δ H = -286 кДж). Тази реакция е екзотермична и се характеризира със значително термичен ефект. Нищо чудно, че смята за ефективно водородно гориво на бъдещето.
При образуването на всяко съединение се освобождава (абсорбират) от същото количество енергия, тъй като се абсорбира (освободен) по време на разпадане в изходните материали.
Поради това, реакцията на разлагане на водата електрически ток се нуждае от енергия и разходи е ендотермичен:
Н2 О (х) = Н2 (д) + 1/2 2 (г) - 286 кДж (ДН1 = + 286 кДж).
Това е следствие от закона за запазване на енергията.
Повечето термохимични изчисления въз основа на най-важните закони на термохимия, което е законът на Хес. Този закон, създаден български учени GI Хес през 1840, също като основния закон на термохимията.
Този закон гласи:
топлинен ефект зависи само от началната и крайната състояния на материята и не зависи от етапа на междинните процеси.
Например, топлинният ефект на реакцията на окисление на въглероден (графит), въглероден оксид (IV) не зависи от това дали се извършва в един етап на окисляване (чрез директно изгаряне на въглерод) във въглероден диоксид:
или реакцията протича през междинен етап на образуване на въглероден оксид (II):
последвано от изгаряне на въглеродния монооксид във въглероден диоксид:
В двата процеса, процесът на системата преминава от същото начално състояние (графит) в същата крайното състояние на въглероден оксид (IV). В съответствие с право Hess топлината на реакция 1 е сумата от термичните ефекти от реакции 2 и 3:
Използването на закона Хес може да се изчисли топлинният ефект от междинния етап на реакция, ако знаем общото количество топлинна енергия за реакция и топлинни ефекти другите си междинните етапи.
Пример за решаване на проблема на термичен ефект.
Реакцията на окисление на глюкоза в организма може да се получи както следва:
Какво е количеството топлина, освободен по време на окислението на 800 грама глюкоза?
Отговор. В резултат на окисляване на споменатото количество глюкоза освободен 12,458 кДж на топлина.