Относно киселинни и основни органични съединения
За да се образуват разбиране на въздействието на киселина-база свойства на органични съединения, много физико-химични и биологични процеси в условията на тялото студенти.
Обучава студенти за определяне на киселинно-основни свойства на алкохоли, феноли, тиоли и амини, в зависимост от тяхната структура.
Студентът трябва да знаят: вида на киселини и основи Бронстед.
Учениците трябва да могат да: определя киселинни и основни свойства на органични съединения.
Модерни идеи за киселини и основи. Брьонстед и Лоури
Важни аспекти на реакцията на органични съединения е техните кисели и основни свойства. За описване на киселинни и основни свойства на химически съединения има няколко теории - Bronsted и Lowry теория, теория Lewis и редица други. Най-често е теорията на Брьонстед и Лоури, или протолитично теория.
Според Bronsted Теория - Lourikisloty - неутрална молекула или йон способен отдаваща протон (протонни донори) и основата - е неутрални молекули или йони, способни на свързване протон (протон акцептори).
Според теорията на Lewis киселини - са неутрални молекули или йони, способни на свързване на двойка електрони (електронна двойка акцептори) и основата е - неутрални молекули или йони, способни да даде електронна двойка (електронна двойка донори).
Това означава, че теоретично, всяко съединение, което включва водороден атом, може да се получи протон и проявяват киселинни свойства. Способността да се отдаде протон могат да проявяват не само неутрална молекула, но заредени частици - катиони (NH4 +) и аниони на киселини като солна киселина, ROH, HSO4 - и други.
частици, носещи отрицателен заряд, например С1 - Ролята на базови аниони могат да действат -. ОН -. HSO4. NH3. Основите могат да бъдат неутрални молекули, които включват хетероатом като азот, сяра, кислород, съдържащи неразделен двойка електрони, например ROH алкохоли.
Неутрални молекули или йони, които могат, в зависимост от естеството на втория компонент проявяват свойства киселини или основи се наричат амфотерни.
Теорията на Bronsted - Лоури. Конюгат киселини и основи.
Киселини и основи проявяват свойствата си само в присъствието на един от друг, нито един veschesvto няма да отдаде протон, ако системата не протонен акцептор - база и naoborot.t.e. те образуват конюгатна киселина базова двойка, в която силна киселина, толкова по-слабо е нейната конюгирана основа, и по-силна база, по-слабата му конюгатна киселина.
Киселина, като протонна се превръща в база конюгат и протон приемане основа, се превръща в конюгатната киселина. Киселината обикновено е означен AN, и основата - в
Например: NS1↔ Н + С1 + -. НС1 - силна киселина; С1 - йон - конюгат слаба основа;
CH 3 COOH ↔ СН3СОО - + Н +. СН3 СООН - слаба киселина и СН3СОО - - силна основа йон конюгат.
за-та бази взаимодействие. взаимодействие.
Ние вече каза, че киселинните свойства на съединенията са открити само в присъствието на основа, и основните свойства - в присъствието на киселина, т.е. Той съществува в някои съединения с киселина - база равновесие, за проучването, което се използва като разтворител на Н2 О. По отношение на H2O като киселина или основа определят киселина базови свойства на съединенията.
За слаби електролити киселинност количествено Kraw реакция, който се състои в пренасяне на Н + от киселина на Н 2О като база.
-ta та базови основи киселина
СН3СОО - - ацетат йон, конюгатна основа;
H3 О + - хидрониев йон, спрегнатата киселина.
Използване на стойността на равновесната константа на тази реакция и факта, че концентрацията на N2 О е почти постоянна, е възможно да се определи продукт К · [Н 2О] наречен Kkislotnosti киселинност константа (Ка).
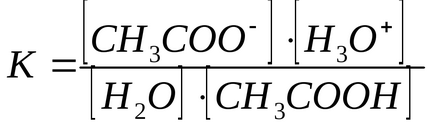
Колкото по-голям Ka. по-силна киселина. За СН3 СООН Ка = 1.75 х 10 -5. такива малки количества, са неудобни в практически операция, следователно, изразена като Ка рКа (рКа = -ℓgKa). За СН3 СООН рКа = 4.75. Колкото по-малко рКа. по-силна киселина.
Силата се определя от бази rKVN +.