Молекулна физика 1
Преходът от твърдо в течно кристално състояние се нарича топене. За да се стопи твърда кристална структура, трябва да се загрява до определена температура, т. Е. Сума топлина. Температурата, при която разтопения вещество се нарича точка на топене вещество.
Обратният процес - прехода от течност към твърдо състояние - настъпва при по-ниски температури, т.е., топлината се отстранява ... Преходът от течност към твърдо вещество се нарича втвърдяване или кристализиране. Температурата, при която материалът кристализира, се нарича температура на кристализация.
Опитът показва, че всяко вещество кристализира и се топи при същата температура.
Фигурата е диаграма на температурата на кристален тяло (лед) от времето за нагряване (от точка А до точка D) и времето за охлаждане (от точка до точка D K). На него, на хоризонталната ос представя времето, а вертикалната - температурата.
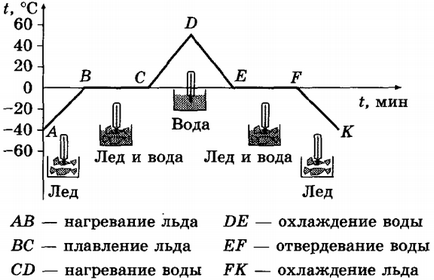
Графиката показва, че процесът започва с точка на наблюдение, където температурата на лед е -40 ° С, или, както се казва, температурата на първоначалното Време Tstart = -40 ° С (точка А в графиката). След допълнително нагряване температурата на леда отглеждане (в графиката е област AB). Повишаването на температурата се появява до 0 ° С - точката на топене на лед. При 0 ° С лед започва да се топи и температурата престава да расте. По време на целия период на сливане (т.е., докато всички ледът се разтопи) температурата на ледена не се променя, въпреки че горелката продължава горене и следователно се подава топлина. Процесът на топене съответства на хоризонталната част на графиките слънце. Само в края на краищата на леда ще се стопи и да се превърне в вода. температурата започва да расте отново (CD раздел). След като температурата на водата достигне 40 ° С, гаси се с горелка, и вода започва да се охлади, т. Е. Топлината се отстранява (това може да бъде контейнер вода се поставя в друг по-голям контейнер с лед). Температурата на водата започва да спада (част DE). Когато температурата достигне 0 ° С температурата на водата престава да намалява, независимо от факта, че топлината, все още се отдава. Този процес на кристализация е вода - леда (хоризонтална част EF). Докато водата се превръща в лед, температурата не се променя. Едва след това лед започва да намалява температура (FK част).
Преглед на графиките се обяснява по следния начин. В участъка на топлина поради въвеждане AB средната кинетична енергия на молекулите на лед увеличава и неговите повишаване на температурата. На цялата част на слънчева енергия, получени съдържанието на колбата, се изразходва за разрушаване на кристалната решетка на лед: подредена пространственото подреждане на молекулите се заменя разстройства, промяна на разстоянието между молекули, т.е. молекулна прегрупиране се случва така, че веществото става течен. Средната кинетичната енергия на молекулите не се променя, следователно остава непроменена и температурата. Допълнително увеличаване на стопен температура лед-вода (в компактдиска част) означава увеличение на кинетичната енергия на водните молекули поради топлинна вход горелка.
При охлаждане вода (част DE) на енергията, която е показано, водните молекули се движат с по-ниска скорост, тяхната средна кинетична енергия на капките - температура намалява, водата се охлажда. При 0 ° С (хоризонтален участък EF) молекули започват да се подредят в определен ред за формиране на кристалната решетка. До приключването на този процес, температурата на веществото няма да се промени, въпреки отпадната топлина, което означава, че течността в втвърдяване (вода) освобождава енергия. Точно това е енергията, която консумира леда, се превръща в течност (сегмент пр.н.е.). Вътрешната енергия на течността е по-голяма от тази на твърдото вещество. При топене (и кристализация), вътрешната енергия на тялото се променя рязко.
Металите се топят при температура над 1650 ° С, се нарича огнеупорен (титан, хром. Молибден и др.). Най-високата температура на топене между тях от волфрам - 3400 ° С. Огнеупорни метали и техните съединения се използват като топлоустойчиви материали в самолет, ракета и пространство инженерство, ядрено инженерство.
Ще подчертая още веднъж, че в топенето вещество поглъща енергия. По време на кристализацията на това, напротив, той го дава на околната среда. Дай определено количество топлина освобождава в кристализацията, средата се нагрява. Той е добре познат на много птици. Ето защо те могат да се видят през зимата при студено време, седнал на леда, който покрива на реката и езерото. Поради отделянето на енергия в образуването на лед въздуха е с няколко градуса по-топло, отколкото на нея в гората сред дърветата, и птиците го използват.
Топенето аморфни вещества.
Наличието на определена точка на топене - това е важна характеристика на кристални материали. Той е на тази основа те могат лесно да бъдат разграничени от аморфни твърди вещества, които също са посочени като твърди частици. Те включват, по-специално, стъкло, много вискозна смола пластмаса.
Аморфен вещество (за разлика от кристален) не са дефинирани точка на топене - те не се стопи и омекотява. При нагряване стъклен лист, например от твърда първата става мека, тя може лесно да се огъне или опъната; при по-високи температури на парче започва да се променя формата под собствената си гравитация. Както отопление на дебелина вискозна маса приема формата на съда, в който се намира. Тази маса е първата дебелина като мед, а след това - като сметана и накрая става почти същия нисковискозна течност като вода. Въпреки това, тези специфични твърдо състояние температура преход на течността не е възможно, тъй като тя не съществува.
Причините за това се крият в радикал разликата на структурата на аморфни твърди вещества от кристалната структура. Атомите в аморфните тела са разположени на случаен принцип. Аморфен тяло в неговата структура прилича на течност. Още в твърди стъклени атоми са разположени произволно. Следователно, повишаване на температурата на стъклото само увеличава движението на молекулите, което им дава постепенно все по-голяма свобода на движение. Следователно, стъклото е омекотена постепенно и не показва рязко преход "твърдо-течност", характеристика на прехода от режим на молекули в строг ред на хаотично.
Топлината на стапяне.
Топлината на стапяне - количеството топлина, което трябва да бъде съобщено вещество при постоянно налягане и постоянна температура, равна на температурата на топене да го превърне напълно от твърдо в течно кристално състояние. Топлината на стапяне равно на количеството топлина. която се освобождава по време на кристализацията на веществото от течно състояние. Чрез топене цялото доставя топлина на вещество е да се увеличи потенциалната енергия на молекулите. Кинетичната енергия не се променя, тъй като топенето се извършва при постоянна температура.
Проучване експериментално топене различни материали със същото тегло, възможно е да се отбележи, че за да ги превърне в течност изисква различно количество топлина. Например, за да се стопи един килограм лед, 332 трябва да се изразходват джаула на енергия и да се стопи 1 кг олово - 25 кДж.
Физическо количество. показваща количеството топлина, необходимо да информира кристален телесното тегло на 1 кг. напълно при температурата на топене се прехвърля в течно състояние, то се нарича специфичната топлина на топене.
Специфичната топлина на стапяне измерва в джаули на килограм (J / кг), и означен с гръцката буква ДълЖината (ламбда).
Специфичната топлина на кристализация, равна на специфичната топлина на топене, тъй като кристализацията се разпределя еднакво количество топлина, която се абсорбира при топене. Например, когато водата замръзва 1 кг разпределени същите 332 джаула енергия, които са необходими за превръщане на масата на лед в вода.
За количеството топлина, необходимо за стапяне на кристалната произволна телесната маса, или топлина на стапяне. е необходимо да се специфичната топлина на топене на тялото, умножена по теглото си:
Количеството топлина, генерирана от тялото, се счита за отрицателно. Ето защо, при изчисляване на количеството топлина еволюира по време на кристализацията на веществото маса м. трябва да използваме същата формула, но със знак "минус":
Топлината на изгаряне.
Топлина на изгаряне (или топлинна стойност на калории.) - количеството топлина, освободен от пълното изгаряне на горивото.
За отопление органи често използват енергията, освободена от изгарянето на гориво. Конвенционалните горива (въглища, нефт, газ) съдържат въглерод. В горивната въглеродни атома се комбинират с кислородни атоми. съдържащи се във въздуха, което води до образуването на молекули въглероден диоксид. Кинетичната енергия на тези молекули е по-голяма от тази на частици прекурсорни. Увеличаването на кинетичната енергия на молекулите в процеса на горене, посочена освобождаването на енергия. Енергията, освободена от пълното изгаряне на горивото и има топлина на изгаряне на горивото.
Топлината на изгаряне зависи от вида на горивото и неговата маса. Колкото по-голяма от масата на горивото, толкова по-голямо количество топлина, отделяща се при пълното му изгаряне.
Физическо количество. показваща количеството топлина, освободен по време на пълното изгаряне на горивото от 1 кг, тя се нарича специфична топлина на изгаряне. Специфичната топлина на изгаряне, определен от буквата Q и измерва в джаули на килограм (J / кг).
Р. Броят на топлината, освободена при горене на гориво кг m се определя по формулата:
За да разберете количеството топлина, освободен от пълното изгаряне на горивото произволна маса, имате нужда от специфична топлина на изгаряне на горивото, умножена по теглото му.