Минерали и минералогия - е

Фиг. 1. Структура на Галит (NaCl) NaCl. Броят на хлорен йон (сиви сфери) е равен на броя на натриеви йони (черни топки).

Фиг. 2. флуорит, CaF2. Флуор йон (сиви сфери) е два пъти на калциеви йони (черни топки).
Стойността на йон също зависи от възможността на възникването им в кристална структура. Ако йоните са със същия размер и опаковани по такъв начин, че всеки йон в контакт с други 12, те са в координация. Има два начина на опаковане на сфери с еднакъв размер (Фигура 3.): Cubic близкото опаковка обикновено води до образуването на кристали и изометрични шестоъгълни близки опаковани шестоъгълни кристали, съставляващи. Обикновено, катиони са по-малки от аниони, и техните размери са изразени в части от радиуса на анион, взети като едно цяло. Обикновено те се използват съотношение получава чрез разделяне на радиуса на катиона на радиус анион. Ако в съоб е само малко по-малко от анионите, които се комбинират, той може да влезе в контакт с осемте околните аниони, или, както се казва, е в осемкратно координация във връзка с аниони, които са подредени така да се каже в ъглите на куб около него. Тази координация (също наречен кубичен) стабилна връзка с йонната радиуси от 1 до 0,732 (фиг. 4а). С по-малко предвид йонни радиуси на осем аниони не могат да бъдат подредени така, че да се справят с катиони. В такива случаи, геометрията на опаковане позволява шесткратно нагънат координация на катиони с аниони, разположени в шест върховете на октаедър (Фиг. 4Ь), който е стабилен в съотношение им радиуси от 0.732 до 0.416. С допълнително намаляване на относителните размери катион движи до четирикратни или четиристенен координацията, стабилна при стойности на съотношението на радиуса на 0.414 до 0.225 (Фигура 4 инча), след това три пъти - в рамките на връзката на радиусите на 0.225 до 0.155 (Фигура 4. д) и двойно - най-малко 0.155 радиуси връзка (Фигура 4 г) .. Въпреки че други фактори определят вида на координация polyhedra, за повечето минерали принцип съотношение радиуси на йони - ефективно средство за кристална структура предсказване.

Фиг. 3. плътната опаковане на сфери. Позицията на първия слой на топки е показано от черни кръгове. Вторият слой е образуван чрез натрупване на топките над празнини между топките на долния слой (показан nezachernennymi кръгчета). Третият слой може да се положи по два начина. Поставянето на топки в интервали (H), разположени над топките на първия слой, гъста хексагонална опаковка. Поставянето на топките на интервали (С) втори слой, разположен над междините на първия слой, ние получаваме кубичната близкото опаковка.
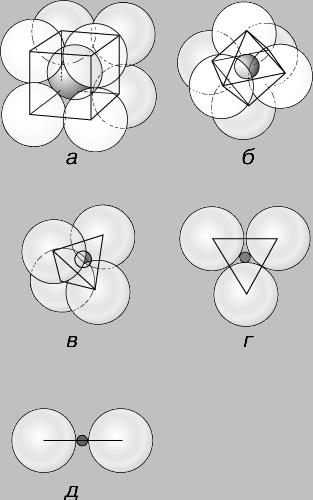
Фиг. 4. многостен на координация формира чрез поставяне на аниони около катиони. Възможни видове местоположение зависи от относителния размер на аниони и катиони. Разграничаване на следните видове координация: а - кубична, или осем пъти координация; б - осмостенна или зъбно колело; в - тетраедър, или четворна; г - триъгълна или тройна координация; др Двоен координация.
Относително твърдост на минерална
Талк ______1 Гипс _______2 Калцит ____3 Флуорит ____4 апатит _____5 ортоклаз ___6 Quartz ______7 Topaz ______8 Корунд _____9 диамант _____10
За определяне на твърдостта на минерална е необходима за идентифициране на твърдост минерал, който той може да се почеше. Твърдостта на теста ще бъде по-минерален твърдост почеса им минерални, но по-малко от твърдостта на следното по скалата на Моос от минерална. Силата на съединителя, може да варира в зависимост от кристалографски посока, а от твърдостта е приблизителна оценка на силата, тя може да варира в различни посоки. Тази разлика обикновено е малък, изключението е кианит, чиято твърдост 5 в посока, успоредна на дължината на кристала и 7 - в напречна посока. В минералогична практика също се използва за измерване на абсолютните стойности на твърдост (например микротвърдост), използвайки sclerometer устройство, което е изразено в кг / мм2.
Плътност. Масата на атоми на химични елементи варира от водород (лекият) за уран (по маса). При равни други условия маса на материята, състояща се от тежки атоми е по-голям от този на вещество, състоящо се от леки атома. Например, две карбонат - арагонит и cerussite - имат подобна вътрешна структура, но са включени в арагонит леки калциеви атоми, и в cerussite - тежки атоми на олово. В резултат cerussite маса надвишава масата на същия обем на арагонит. минерална маса за единица обем също зависи от плътността на опаковане на атомите. Калцит, като арагонит, е калциев карбонат в калцит атома, но по-малко плътно опаковани, защото има по-малка маса на единица обем от арагонит. Относителна маса или плътност, зависи от химичния състав и вътрешната структура. Плътност - съотношението на маса на веществото към теглото на същия обем вода при 4 ° С този начин, ако минерално тегло от 4 д, и теглото на същия обем вода - 1 гр, минералната плътност на 4. В минералогия обичайно да изразят плътността в г / cm3. Плътност - важен диагностичен черта на минерали, както и че не е трудно да се измери. Първо пробата се претеглят във въздуха и след това - във водата. Тъй като пробата е потопена във вода, плаващ силата, действаща нагоре посочи теглото си има по-малко от въздуха. Загубата на тегло, равно на теглото на водата изместена. По този начин, плътността се определя от съотношението на масата на пробата на въздух до загуба на тегло във вода.
КЛАСИФИКАЦИЯ НА МИНЕРАЛИ
Въпреки че химичният състав послужи като основа за класификация на минерали от средата на 19-ти век. минералозите не винаги споделят едни и същи възгледи за това какво трябва да бъде от порядъка на минералите в нея. Според един от методите за класификация, минералите, които са групирани в една и съща основна или метален катион. В този случай, минерали желязо попадат в една и съща група, доведе минерали - други цинкови минерали - в третата и т.н. Въпреки това, с развитието на науката това е установено, че минералите, съдържащи същото неметални (анион или анионна група) имат подобни свойства и подобни един на друг много повече от общите метални минерали. В допълнение, минералите с обща аниони, намиращи се в една и съща геоложките условия и имат сходни произход. В резултат на това в съвременната таксономия (вж. Таблица. 2) минерали са комбинирани в класове от общата анион или анионна група. Единственото изключение е роден елементи, които се срещат естествено на собствената си, не образуват съединения с други елементи.
Таблица 2.
КЛАСИФИКАЦИЯ НА МИНЕРАЛИ
Химични класове са разделени на подкласове (за химията и структурни мотиви), което, от своя страна, се разделят на семейства и групи (структурен тип). Отделните минерални видове, принадлежащи към групата могат да образуват редове и един минерални видове могат да имат няколко разновидности. В момента са ок. 4000 минерали са признати за независими минерални видове. Към този списък се добавя като откриването на нови минерали и изключени отдавна известни, но дискредитирани с подобряването на минералогични изследователски методи.
ПРОИЗХОД И УСЛОВИЯ ЗА ОПРЕДЕЛЯНЕ НА МИНЕРАЛИ
Минералогия не се ограничава до определянето на свойствата на минерали, но и изследва произхода и условията за намиране на природен асоциация минерали. От началото на Земята преди около 4,6 милиарда. Години много минерали са разрушени в резултат на механично смилане, химични трансформации или топене. Но елементите, които съставляват тези минерали са запазени, прегрупирани и формира нова минерали. По този начин, в момента съществуващите минералите са продукти на процеси, които са се развили през геоложката история на Земята. Повечето от земната кора се състои от вулканични скали, които се припокриват по отношение на тънка покривка от седиментни и метаморфни скали. Поради това, в състава на земната кора, по принцип съответства на средното състава на магмени скали. Осем елементи (вж. Таблица. 3) представляват 99% от теглото, съответно, на кората и 99% от теглото на съставните минерали.
Таблица 3.
Основният елемент, част от земната кора

Арагонит кристали - метастабилна модификация на калциев карбонат.

MALAKHIT - основен меден карбонат има цвят от светло зелено до тъмнозелено.

ПОЛИРАНА AGGREGATE малахит

Колоноидните кристали Pink Турмалинови