Скоростта на химическа реакция
Скоростта на химична реакция. Определение.
Химични реакции протичат при различни скорости. От добре познат до този момент, най-бързите реакции се случва в 10 до 40 пъти по-бързо от най-бавно. Превръщането на графит в диамант в недрата на земята - много бавен отговор. Смес от кислород с водород експлозия се появява почти мигновено.
Как да се сравни честотата на реакциите количествено?
Скорост - промяна в някои количество с течение на времето.
H2 + I2 = 2HI
Опитайте се да се определи скоростта на реакцията на разходите на реагенти за единица време. Така например, по следния начин:
V (Н2) = М (Н2) / D Т, V (I2) = М (I2) / D тон
където V - скорост на реакцията, m - маса затихва подходящ реагент, D т - интервал от време.
Но V (H2) не е равно на V (I2). Масите на водород и йод взаимодействат в единица време не е равен.
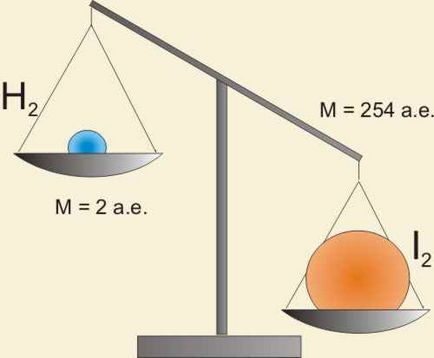
Реакцията се провежда в моларно съотношение 1: 1, но не и в масата! Нека се опитаме по друг начин:
V (Н2) = N (Н2) / D т, о (I2) = N (I2) / D тон
вместо като масовото количество вещества.
V (Н2) = V (I2)
Но ако в първия случай ние се броят на моловете намаление за единица време в 1 мл смес, а вторият - в 1 л смес, скоростта ще бъде равен отново! Те зависят от силата на звука. Ако се направи същата реакция в малка епруветка и в голям резервоар, ин витро реагира малък брой вещества - просто, защото има по-малко реагент.
И ако в резултат на тези изрази на обема на единица?
V (Н2) = N (Н2) / V D т = D в (Н2) / D т, о (I2) = N (I2) / V D т = D в (I2) / D тон
където D в промяна на моларни концентрации на съответните вещества.
Тогава VH2 = vI2 = срещу тази реакция!
По този начин, крайният Определението ще бъде:
Скоростта на химическа реакция - промяна в един от моларната концентрация на реагентите за единица време: