производство на аминокиселини
Между съединенията, получени чрез биотехнологични методи, аминокиселини на първо място по отношение на производството и втората най-високата стойност зад последния параметър антибиотици. Глобалната производството на аминокиселини е повече от 500 хил. Тона годишно. Въпреки това, това количество - само малка част от желания брой аминокиселини. Според СЗО, човешки трябва само четири основни аминокиселини е, милиона тона: лизин - 5, метионин - 4, треонин - 3.7 и триптофан - 2.
В промишлен мащаб протеин аминокиселини са:
· Хидролиза на природни протеини, съдържащи суровини;
· Биотрансформацията на прекурсор аминокиселини използват микроорганизми или ензими, изолирани от тях (химически и микробиологичен метод).
Хидролиза на природни протеини, съдържащи суровини. Хидролизата на суровини, съдържащи протеин (хранителни отпадъци и млечната промишленост) се нагрява с разтвори на киселини или основи при температура от 100 - 105 ° С в продължение на 20 -. 48 часа, най-често се използва 20% разтвор на солна хидролиза киселина на протеин осигуряване дълбоко. По време на киселинна хидролиза рацемизация срещащи се протеини и унищожаване на някои от техните съставни аминокиселини. В кисела хидролиза триптофан напълно унищожени и само значителна загуба на цистеин, метионин и тирозин (10 - 30%). Освен това, за да се ускори реакцията на хидролиза на протеини, използващи имобилизирани протеолитични ензими и йонообменни смоли. Аминокиселини, получени чрез хидролиза се използват в медицината, животновъдството, храна и микробиологични индустрии.
Химически синтез. Използвайки метода на химически синтез на аминокиселини от желания продукт се получава под формата на рацемична смес от D- и L-стереоизомерни форми. По-голямата част от природна аминокиселина се отнася до L-серия. D- # 945-аминокиселинен само в състава на гликопротеините на клетъчните стени на бактерии, антибиотици и някои токсини. Пропускливостта на L-амино киселини в клетка 500 пъти по-голяма от антипод. Стереоспецифичност и транспорт и метаболизма на аминокиселини. Разделянето на рацемата на други аминокиселини - изключително скъпо и отнема много време процедура.
Изключение в това отношение е метионин, който nestereoizbiratelen метаболизъм, като тази аминокиселина за предпочитане се получава чрез химичен синтез, който е икономически по-изгодно в сравнение с микробиологичен метод.
Микробиологично синтез. Най-обещаващи и икономически изгодно микробен синтез на аминокиселини. Над 60% от всички понастоящем произведени търговски високо пречистени препарати на протеин амино киселина се получава по този метод, което е голямо предимство в сравнение с методите за химичен синтез е възможността за получаване на L-амино киселини на базата на възобновяеми суровини.
Повечето от дивите щамове от микроорганизми, способни да продуцират аминокиселините в околната среда в много малки количества. Сред възможните организми глутаминова киселина получаване маркирани, от които 30% - дрожди, 30% - стрептомицетите, 20% - 10% от бактерии и - микроскопични гъбички.
Обещаващи щамове, произвеждащи мутанти чрез непрекъснато подобряване разплод с променена генетична програма и регулаторни свойства. Общата избор Предмети на производителите - микроорганизми, които принадлежат към рода Бревибактериум, микрококус, Corynebacterium, Arthrobacter (таблица 8.1.).
Микроорганизми - производители на аминокиселини
Б. флавум, С. glutamicum
получаване на единична аминокиселина развитие технологична схема се основава на знанието на начини и механизмите, регулиращи биосинтезата на отделна аминокиселина. Задължителни метаболитни дисбаланси, които предоставят изразяването продукт заглавие, издирван от строго контролирана състав и промени в условията на околната среда.
лизин производство. Пътека и охарактеризиране на производителите. лизин микробни клетки се синтезира от аспарагинова киселина и крайният продукт е с разклонена метаболитен биосинтетичен път, обща за трите аминокиселини - лизин, метионин и треонин (Фигура 8.2). По време на образуването на аминокиселини от един общ предшественик заедно с лизин, има две други аминокиселини - метионин и треонин. В този случай, на ефекта на натрупване в средата на само една цел аминокиселина търси чрез блокиране на процесите, водещи до синтеза на страна аминокиселина произтичащи разклонена път.
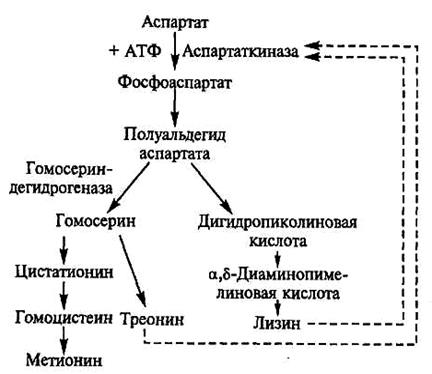
Ензимът aspartokinase отваряне метаболитен път е алостеричен протеин чувствителен към инхибиране чрез обратна връзка по съвместно и координирано действие страничните продукти от L-треонин и L-лизин.
Фигура 8.2. Схема лизин биосинтеза, метионин и треонин в клетките на Corynebacterium glutamicum и Бревибактериум флавум
С натрупването на лизин и треонин в излишък концентрация Ingi-biruetsya aspartokinase и тяхната синтеза спира при ниски концентрации на всеки от двата аминокиселини активирани процес.
За да се постигне БРАЗОВАНИЕ на лизин в големи количества, са мутанти на два вида. В мутанти първи тип не се синтезира или не функционира хомосерин, получената блокира синтеза на метионин и треонин. Такива мутанти са ауксотрофни за хомосерин или треонин (метионин); вътреклетъчни концентрации на треонин са значително намалени, което отстранява блокадата на аспартат.
Мутанти дефектна в Вторият тип на структурния ген, определящ аспартат киназа конформация. В резултат на ензима губи чувствителността на алостерична инхибитор концентрации - лизин.
Технология на производство. Като източник на въглерод за култивиране на лизин производство се използват вторични суровини: меласа от захарно цвекло, суроватка, нишестени хидролизати, сулфитна луга. Източниците на азот са амониеви соли и карбамид. В допълнение, хранителна среда, необходима за живота добавя макро- и микроелементи (Р, Са, Mg, Mn, Fe и т.н.); стимулатори на растежа, които действат като царевица екстракти, дрожди и малц микроби, трици и дрожди хидролизати, витамини от група В. Степента на аериране е индивидуален за производство на всяка конкретна производителя.
След завършване на процеса на ферментация (след 55 - 72 часа) в течна фаза се отделя от микроорганизъм клетъчна култура чрез филтруване и се използва за изолиране на тях лизин.
Силно пречистени препарати на лизин е получена след фракциониране на културата филтрат чрез йонообменна хроматография на катионен обменник. За тази цел лизин се превръща във форма катион:
За този процес, филтратът се третира със солна киселина до рН 1.6 - 2.0. С две положително заредени йонни групи, лизин твърдо адсорбира върху смолата и се елуира с него като единично съединение 0.5 - 5% разтвор на амониев хидроксид, след като всички други катиони. Елуатът се концентрира под вакуум при 60 ° С, се превръща в под формата на хидрохлорид, след това се суши и се пречиства чрез прекристализация. Така препаратите, получени кристален лизин 97-98% -та чистота, които се използват за подобряване на хранителната стойност на храните и медицински индустрии.
Също така силно пречистени препарати на лизин произвеждат други видове неговите ценни форми: течен концентрат лизин (ZHKL), сух фураж концентрат на лизин (CCL) и силно концентрирани хранителни препарати, характеризиращи се с относително ниска степен на пречистване в сравнение с първото лекарство.
триптофан производство. Пътека и охарактеризиране на производителите. Както лизин триптофан, оформен в разклонена път (ris.8.3).
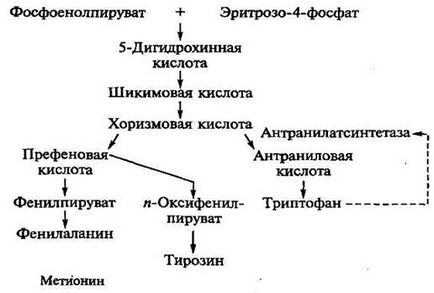
Ris.8.3. Метаболитният път на триптофан синтез
Въпреки това, използването на ауксотрофни мутанти, които са блокирани реакции, водещи до синтеза на фенилаланин и тирозин в средата, се наблюдава прекомерното натрупване на триптофан в средата, поради регулиране характеристика на триптофан биосинтеза в микроорганизми. Метаболитен прекурсор триптофан е антранилова киселина, която възниква от chorismic киселина при antranilatsintetazy. Триптофан има инхибиторен ефект върху antranilatsintetazu следователно край на метаболитния контрол на стъпаловидно синтез на ензима се индуцира чрез въвеждане на прекурсорния - антранилова киселина.
Във връзка с тази функция на промишленото производство на триптофан е организирана главно на схема на два етапа.
Технология на производство. В първия етап химически синтезиран антранилова киселина, която чрез ензимна система Candida utilis мутантни щамове дрожди превръща триптофан.
След сушене на получената култура течен фураж концентрат триптофан (CCV), който съдържа протеин, свободен триптофан, витамини В1, В2 и PP. Силно кристални препарати триптофан, образувани след допълнително пречистване на културалната течност чрез йонообменна хроматография на колона, напълнена с катионобменна смола (сорбция при рН 1.0; елуиране с 5% амониев хидроксид в смес с 2-пропанол). Елуатите се кристализира; кристали се промиват и сушат. формулировка Кристална съдържа до 99% от триптофан.
Освен триптофан микробиологичен метод с използване на прекурсор подготвени хистидин, изолевцин, метионин, серин и треонин.
Химичен и микробиологичен метод. През последните години, в производството на аминокиселини са все използване биотрансформация аминокиселинни прекурсори киселина при използване на имобилизирани ензими или микроорганизми клетки предварително получени чрез химически средства.
Използването на ензими в производството на аминокиселини стереоспецифичност осигурява методи за техния синтез, която разграничава биотехнологична продукция на химикали.
Получаване на L-лизин. Методът се основава на получаване на лизин стереоспецифичен ензимна хидролиза (преобразуване) D-, L- # 945; # 949-амино-капролактам, който се получава първи по химичен път от циклохексан:
Рацематът се използва като субстрат, който ензимът L- # 945, # 949 амино; -kaprolaktamgidrolazy (лактамаза) се превръща в L-лизин, и останалата част от нереагирал (D-форма) се превежда под действието на рацемаза в смес от антиподи:
Първи триптофан. Химическа-ензимен метод за получаване на триптофан е пряка кондензация на индол пирогроздена киселина и амоняк:
Катализира реакция piridoksalzavisimaya tryptophanase на. Ензим, намиращ се в бактерии Е. коли, Bacillus albei. Proteus rettgeri и се характеризира с широка субстратна специфичност. Добавянето на триптофан да индуцира образуването на ензима, и прибавяне на индол да инхибира неговия синтез в бактерии, така че процесът се провежда при производството на амоняк триптофан и излишък пируват. Добив аминокиселини в прилагането на химически-ензимен метод за получаване на триптофан е 63 г / л.
Списък на целевата амино киселина, получена чрез химично-ензимна метод се променя (L-аспартова киселина, L-аланин, L-глутамин, L-лизин, L-тирозин, L-триптофан, L-цистеин, L-фенилаланин, L-метионин). Химическа-ензимна процес в сравнение с микробиологични повече специфични аминокиселини не изискват процедури за пречистване на странични продукти и отпадъци. Въпреки това, цената на суровините и ензимните препарати, тя все още е по-малък от микробиологична метод.
Използването на аминокиселини. Освен използване като хранителни добавки, аромати и овкусители аминокиселини, използвани като суровина в химическата, парфюмерийната и фармацевтичната промишленост и при производството на редица други вещества