Молекулата на водата
Вода (водород оксид) Н2 О - простият стабилно съединение от водород с кислород. 18.0160 Молекулно тегло вода, в водород трябва да 11,19% от теглото, и кислород - 88,81%.
Както вече споменахме, в природата има три изотопи на водород - 1 Н лек водород деутерий D (Н2) и тритий (Н 3) и три изотопи на кислород - 16 О О О 17 и 18. изкуствено приготвени ускорители супертежък водородни изотопи H 4 и Н 5 и шест кислородни изотопи: три светлина - O O 13. 14. 15. две тежки - 19. O O 20 и SuperCarrier - O 24. Теоретично, пет и девет водородни изотопи на кислород изотопи могат да образуват 135 разновидности на водна молекула , от които девет са стабилни, включващи стабилни изотопи. В природна вода делът Около 16 има 99,75% от теглото, делът 18 О - 0,2%, на D 17 - 0.04% и N 1 Н 2О 16 - около 0,093%; другите пет вида присъстват в незначителни количества. [4]
Структурата на водата
Молекулата на вода има ъглова структура: въвеждане в структурата на ядрото образуват равнобедрен триъгълник, на базата на които две са водород, и най - кислородния атом. Internuclear разстояние О - N близо до 0.1 пМ, разстоянието между ядрата на водородните атоми е 0.15 пМ. От шест електроните съставляващи външен електронен слой на кислородния атом в молекулата на вода, два електронна двойка за образуване на ковалентна връзка О-Н и останалите четири електроните два несподелени електронни двойки (фигура 1).
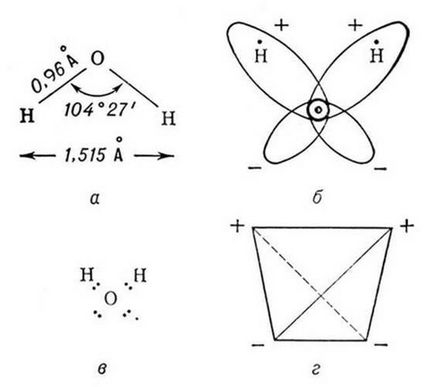
Фигура 1 - Модели на структурата на водните молекули [3]
молекулата на водата е малък дипол съдържащ положителните и отрицателните заряди в полярните области. Приблизително водородни ядра има недостатък на електронната плътност и на противоположната страна на молекулата около ядрата кислородните наблюдавани излишък електронна плътност. Тя е тази структура и определя полярността на водните молекули. Ако свържете с прави линии на епицентъра на положителни и отрицателни заряди, обръщане на обем геометрична фигура - редовен тетраедър (Фигура 1) [19,20].
От гледна точка на образуването на метод валентна връзка на химически връзки в водните молекули може да се обясни поради припокриването на двата р-он-електронен облак кислородни атоми и S-един електрон облаци на два водородни атома. Като се има предвид, че участва в образуването на химични връзки р-облак от кислород са разположени една спрямо друга под ъгъл от 90, ъгъл валентността HOH следва също да съответства на тази стойност. В действителност обаче, той композира 104.5. ъгъл Бонд отклонение от очакваните може да се обясни от две гледни точки.
Съгласно един от тях се увеличи ъгъла на връзка от 90 до обясни 104,5mozhno отблъскване водородни атоми, които поради голямата разлика в Електроотрицателност на кислород (разлика от 1,4 по скалата на Полинг) вземат в молекула вода частичен положителен заряд (плюс 0.33 всеки атом). ефективно зареждане кислороден атом е минус 0.66.
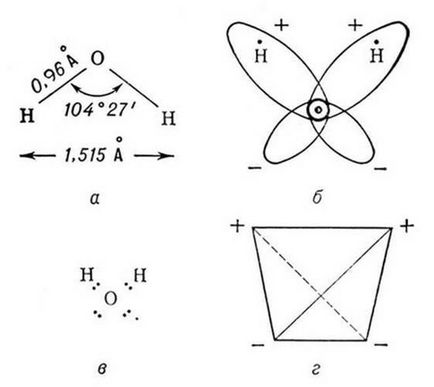
От гледна точка на хибридизация концепция кислороден атом трябва да бъде в състояние на SP 3 хибридизация, в която участват две орбитален с несподелени електронни двойки и две орбитален извършване комуникация с водород. Следователно, ъгълът на връзка между tetrahedrally разположени орбитите на кислород в пространството трябва да бъде около 109.5. HOH ъгъл връзка отклонение на тетраедър може да се обясни с факта, че електронната двойка от О, - Н заемат място малък обем от неразделен двойка кислород [3].
Особености на структурата на водните молекули имат важни последици.
Първо, поради неравномерното разпределение на електронната плътност на валентните електрони Н2 О молекула е дипол с отрицателен полюс на положителните и кислорода от водороден атом. момент дипол на вода е 6.1710 -30 ХМЛ. Това е доста голяма стойност. За сравнение, етап дипол е 0 метан, амоняк - 4.4410 -30 ХМЛ.
Второ, голяма диполен момент на вода е причина за дипол-дипол и йон-дипол взаимодействия във водни разтвори.
Трето, водните молекули образуват водородни връзки.
Четвърто, неразделен електронна двойка кислород позволява Н 2О да действа като лиганд за образуване на комплексни съединения [3].
Водата има много висока точка на замръзване (0) и точка на кипене (100) (Фигура 2). Това позволява да съществуват във всички състояния на агрегация: твърдо вещество (лед), течен (вода) или газообразен (пара) (Фигура 3).
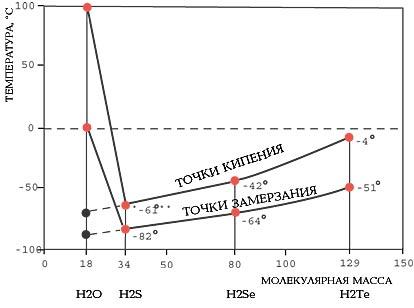
Фигура 2 - Аномалии на точки на кипене и замразяване

Фигура 3 - Състоянията на водни единици: А - лед б - вода в - двойки [2]
От единични молекули вода е в състояние на пара. При температура под точката на кипене, когато кинетичната енергия на молекули става намали тяхната потенциална енергия, вода, както и всяко вещество, в този случай става течен. Но температурата на фазовия преход на водата почти 200vyshe отколкото би се очаквало от естеството на междумолекулни взаимодействия да се извършва между подобно на това в молекулата, като водороден сулфид.
Високата полярността на вода е само една от причините за асоцииране на водните молекули, които могат да бъдат комбинирани с два, три или повече поради взаимното привличане на противоположно заредени края на дипол [3].
Основната причина за образуването на сътрудници (Н 2О) х са водородни връзки [3]. В твърдо състояние кислородния атом на всяка молекула вода образува два водородни връзки (показани с пунктир) със съседните молекули чрез схема (Фигура 4) [4]. Благодарение на тях, на вода в течно състояние - не е нарушено движение на молекулите, а държавата в близост до аморфна. При това молекулите на вода са свързани в агрегати (Н2 О) Х - степента на асоцииране клъстери (130) и водни молекули на 0, 90 - на 20, 60-72 (фигура 5) [3].
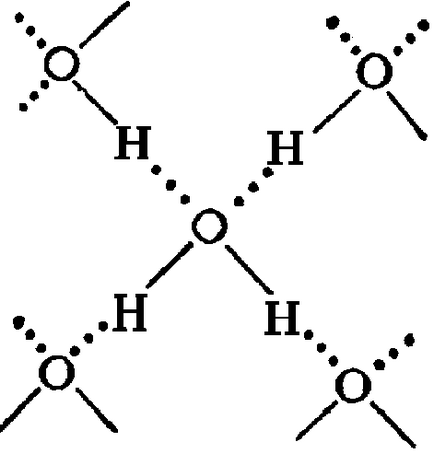
Фигура 4 - схема на образуването на водородни връзки [4]
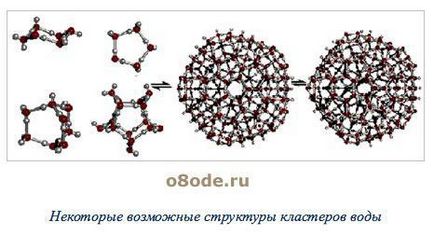
Фигура 5 - някои от възможните структурата на водните клъстери
Животът на такива клъстери малък (10 -11 - 10 -10 секунди). Тяхното образование не е всички молекули, участващи в противен случай плътността им в течно състояние би трябвало да бъде в 1 г / см 3 и 1,84 гр / см 3. Последната стойност се изчислява на поемането на близо опаковане на молекулите H2O с радиус равен на 1 38, която се определя от кристалната решетка с размер на лед [3].
Схема лед кристална решетка е показана на Фигура 6. Всяка молекула на Н2 О (черни топки) tetrahedrally заобиколен от четири други молекули - три от същия слой и слой съседни молекули. Структурата на леда е по-малко плътна структура. функцията му е присъствието на кухини по-голям от молекулни размери Н2 О. Когато лед се топи част на водородни връзки се разрушава и останалите звена в кухините могат да се настанят отделните водни молекули, като по този начин се постига по-плътна опаковка на молекулите. Следователно, топенето на обем ледена вода намалява и се увеличава плътността.
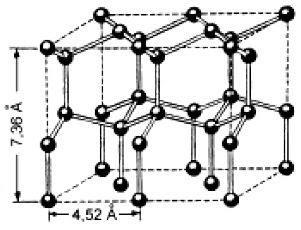
Фигура 6 - лед кристална решетка [4]